新聞資訊 了解首宏動態、掌握行業資訊
11月25日,國家藥監局消息,發布了關于批準注冊43個醫療器械產品的公告(2019年第96號)。
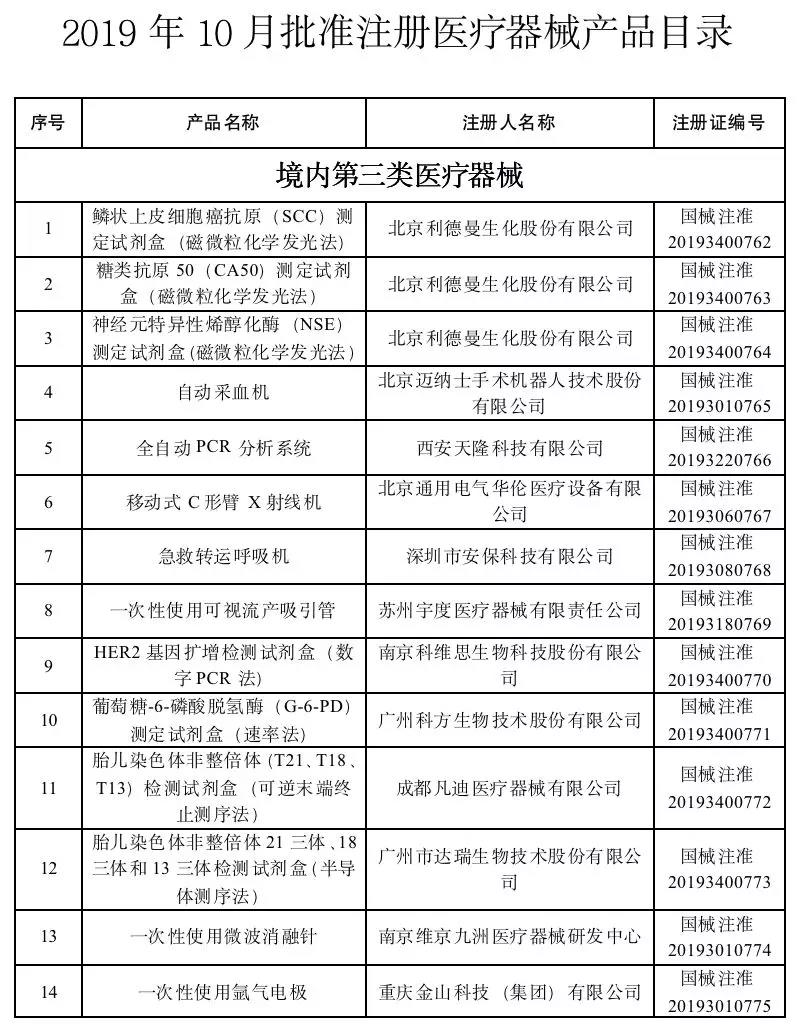
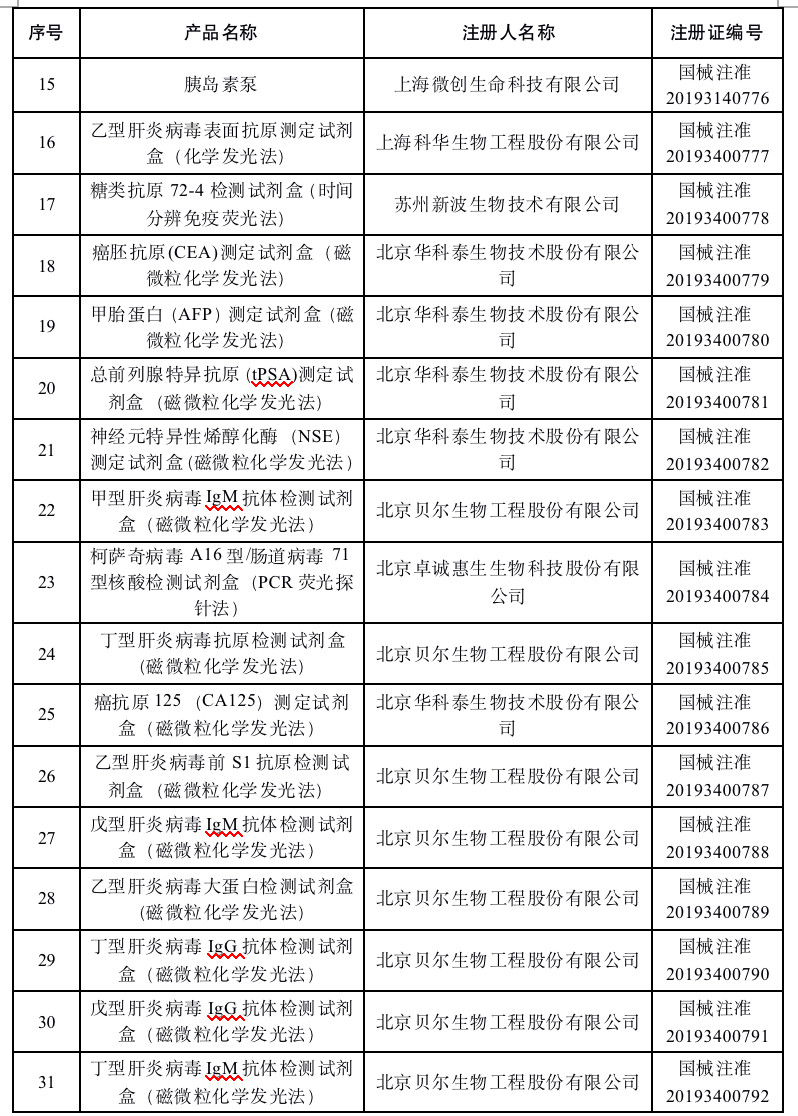
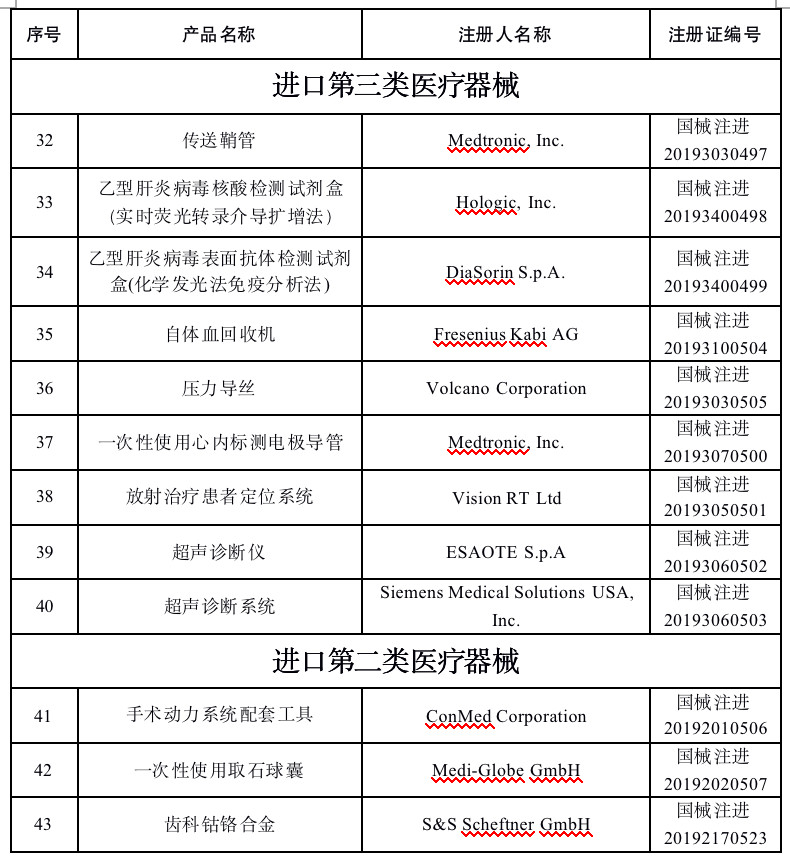
2019年10月,國家藥品監督管理局共批準注冊醫療器械產品43個。其中境內第三類醫療器械產品31個,進口第三類醫療器械產品9個,進口第二類醫療器械產品3個。
此外,首宏了解到,國家藥監局對創新性醫療器械也是一直大力扶持。
國家藥監局貫徹落實《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號)和《中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),深入推進醫療器械審評審批制度改革,加速醫療器械創新發展。
自《創新醫療器械特別審批程序》發布以來,截止2018年12月31日,已有197個產品進入創新醫療器械特別審查通道,批準神經外科手術導航定位系統、正電子發射斷層掃描及磁共振成像系統等54個產品注冊,一批創新性強、技術含量高、臨床需求迫切的創新產品上市,填補了相關領域的空白,更好的滿足了人民群眾的健康需求。
從批準產品所在地來看,產業大省創新醫療器械數量排名靠前,分別是北京18個、上海10個、廣東10個、江蘇8個。從批準產品的類型來看,植入類醫療器械22個,診斷類設備9個,體外診斷試劑13個。
對于進入創新醫療器械審評審批通道的產品,國家局通過早期介入、專人負責、多次溝通、專家咨詢等方式開展科學審評審批,在“標準不降低、程序不減少”的前提下,對創新醫療器械予以優先辦理。
據統計,對創新優先平均審評審批時間較其他普通三類首次注冊產品平均壓縮83天,創新產品從研發到上市的時間進一步縮短。
為更好地實施創新醫療器械特別審批制度,2018年11月,國家藥監局發布了新修訂的《創新醫療器械特別審查程序》。
修訂后的程序設置更科學合理,有利于進一步集中力量,提高效率,促進醫療器械產業創新發展。
首宏整理了2019年10月批準注冊的醫療器械產品目錄,見下表:

首宏醫療控股集團股份有限公司 地址:山東省青島市南區南京路8號府都大廈 16、20-22 層 聯系電話:400-699-8388
Copyright @ 2018 Safehigh ALL Right Reserved.
ICP備案:魯ICP備19047490號-1